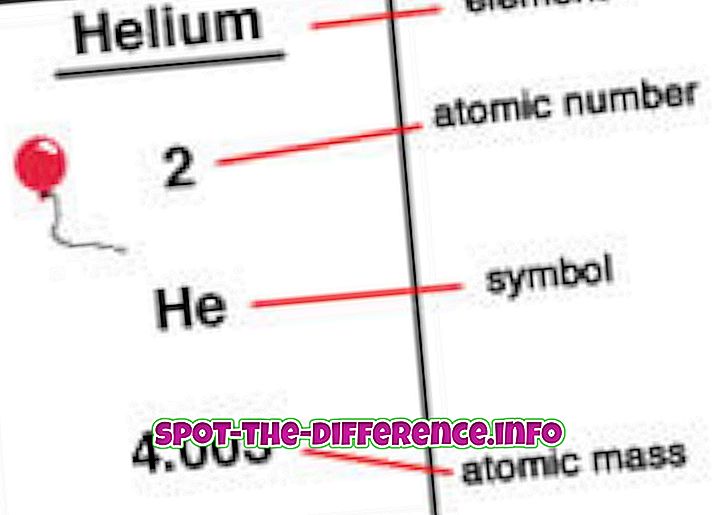
Keskeinen ero: Atomimassa on yksinkertaisesti tietyn isotoopin massa tai atomin protonien, neutronien ja elektronien yhdistetty massa. Atomiluku on elementtien ytimessä esiintyvien protonien lukumäärä.
Kohtaamme, että kemia on sekava, eri elementtien määrä, atomiluvut, sidokset, massa, paino, atomit jne. Kaikki nämä sanat alkavat hämärtyä tietyn ajan kuluttua, jonka ihminen ei voi enää erottaa toisistaan. Hyvin atomiaine ja atomiluku ovat kaksi sellaista sanaa, joita usein sekoitetaan ja käytetään keskenään.
Atomimassa on atomin massa, kun se on levossa. Tämä johtuu siitä, että kun atomi liikkuu hyvin suurella nopeudella, se pyrkii lisääntymään massassa. Vaikka määritelmän mukaan atomimassa on kaikkien protonien, neutronien ja elektronien massa, elektronit ovat liian pieniä, jotta ne voisivat tehdä merkittäviä eroja atomimassaan. Useimmilla jaksollisen pöydän elementeillä on isotooppeja ja neutronien lukumäärän eron vuoksi myös jokaisen isotoopin massa muuttuu.
Atomimassa ilmaistaan atomimassayksiköillä tai amu: lla. Yksi atomimassayksikkö on yhtä suuri kuin 12/12 C-12: n massasta. Kun atomin massa jaetaan hiilidioksidin 12 massan 1/12: lla, saadaan elementin suhteellinen massa. Kohteen suhteellinen massa on kuitenkin elementin atomipaino, koska se lasketaan tarkastelemalla kaikkia isotooppeja. Tätä ei kuitenkaan pitäisi pitää elementin atomimassana.

Atomiluku on elementtien ytimessä esiintyvien protonien lukumäärä. Kun atomi on neutraali, se tarkoittaa, että sillä on sama määrä protoneja ja elektroneja. Atomiluku merkitään Z: llä. Koska jokaisella elementillä on erilainen määrä protoneja, tätä lukua käytetään myös edustamaan elementtiä. Isotoopeilla on yleensä sama atomiluku, mutta ne luokitellaan niiden atomimassaan, esimerkiksi Carbon-12, Carbon-13.
Elementit sijoitetaan atomiarvon järjestykseen jaksolliseen taulukkoon. Atomiluku on elementin vasemmassa yläkulmassa yläindeksinä. Atomiluvut voivat auttaa paljastamaan tietoa elementistä ja monet ihmiset näkevät atominumeron ja ilmoittavat, mikä elementti on. Se kertoo myös, missä jaksollisessa taulukossa se voidaan sijoittaa ja onko se nestettä, kaasua tai kiinteää. Atomiluku antaa myös tietoa ydinlatauksesta, hapettumisolosuhteista, sidontakäyttäytymisestä, ionin varauksesta jne.